A la veille de la publication du rapport de la commission d’enquête du Sénat sur les pénuries de médicament, OTMeds lance un outil pour évaluer de façon rationnelle les politiques pharmaceutiques et sortir du dogmatisme.
Demain matin, la commission du Sénat sur les pénuries de médicaments et les choix de l’industrie pharmaceutique rend son rapport. OTMeds, qui a appelé à la mise en place de cette commission, a élaboré une grille d’évaluation1 des recommandations de ce rapport.
Nous appelons les journalistes à s’appuyer sur cet outil pour analyser et évaluer de façon rationnelle les politiques publiques pharmaceutiques. La situation actuelle en matière de produits pharmaceutiques (contexte géopolitique, ultra-dépendance à la Chine et à l’Inde, augmentation des besoins mondiaux et multiplication par 6 des pénuries de médicaments depuis l’arrivée d’Emmanuel Macron au pouvoir) est dramatique et appelle à sortir d’un dogmatisme dangereux. Cela exige donc une évaluation de ces politiques sur des critères rationnels.
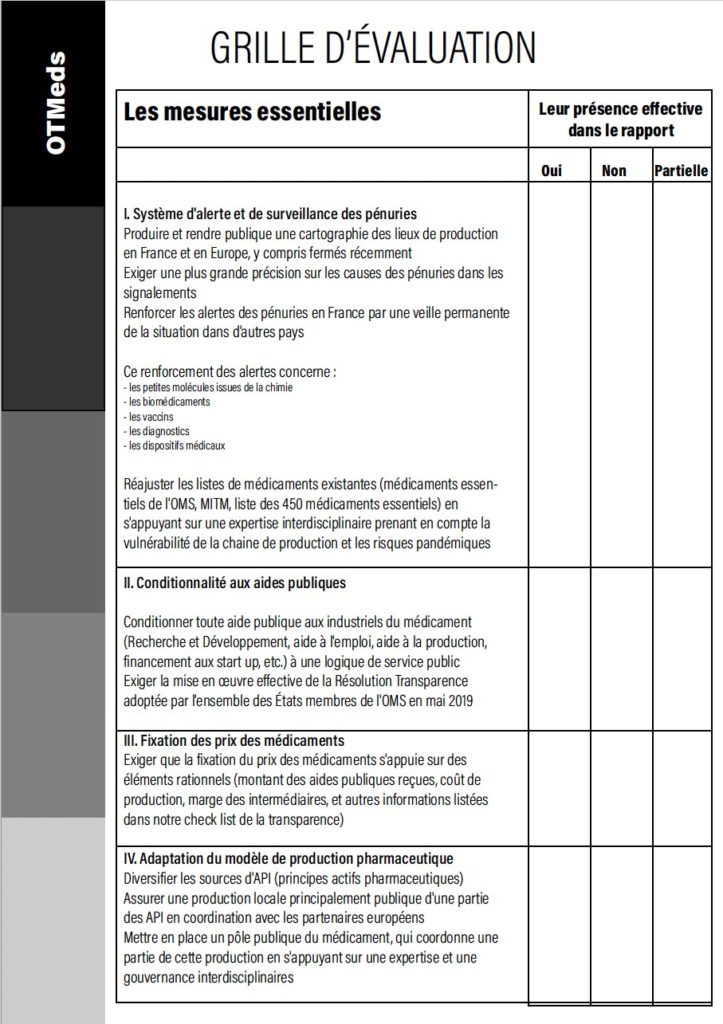
| Les mesures essentielles | Leur effectivité dans le rapport |
| I Système d’alerte et de surveillance des pénuries | |
| Produire et rendre publique une cartographie des lieux de production en France et en Europe, y compris fermés récemment | |
| Exiger une plus grande précision sur les causes des pénuries dans les signalements | |
| Renforcer les alertes des pénuries en France par une veille permanente de la situation dans d’autres pays | |
| Ce renforcement des alertes concerne : – les petites molécules issues de la chimie | |
| – les biomédicaments | |
| – les vaccins | |
| – les diagnostics | |
| – les dispositifs médicaux | |
| Réajuster les listes de médicaments existantes (médicaments essentiels de l’OMS, MITM, liste des 450 médicaments essentiels) en s’appuyant sur une expertise interdisciplinaire prenant en compte la vulnérabilité de la chaine de production et les risques pandémiques | |
| II Conditionnalité aux aides publiques | |
| Conditionner toute aide publique aux industriels du médicament (Recherche et Développement, aide à l’emploi, aide à la production, financement aux start up, etc.) à une logique de service public | |
| Exiger la mise en œuvre effective de la Résolution Transparence adoptée par l’ensemble des États membres de l’OMS en mai 2019 | |
| III Fixation des prix des médicaments | |
| Exiger que la fixation du prix des médicaments s’appuie sur des éléments rationnels (montant des aides publiques reçues, coût de production, marge des intermédiaires, et autres informations listées dans notre check list de la transparence) | |
| IV Adaptation du modèle de production pharmaceutique | |
| Diversifier les sources d’API (principes actifs pharmaceutiques) | |
| Assurer une production locale principalement publique d’une partie des API en coordination avec les partenaires européens | |
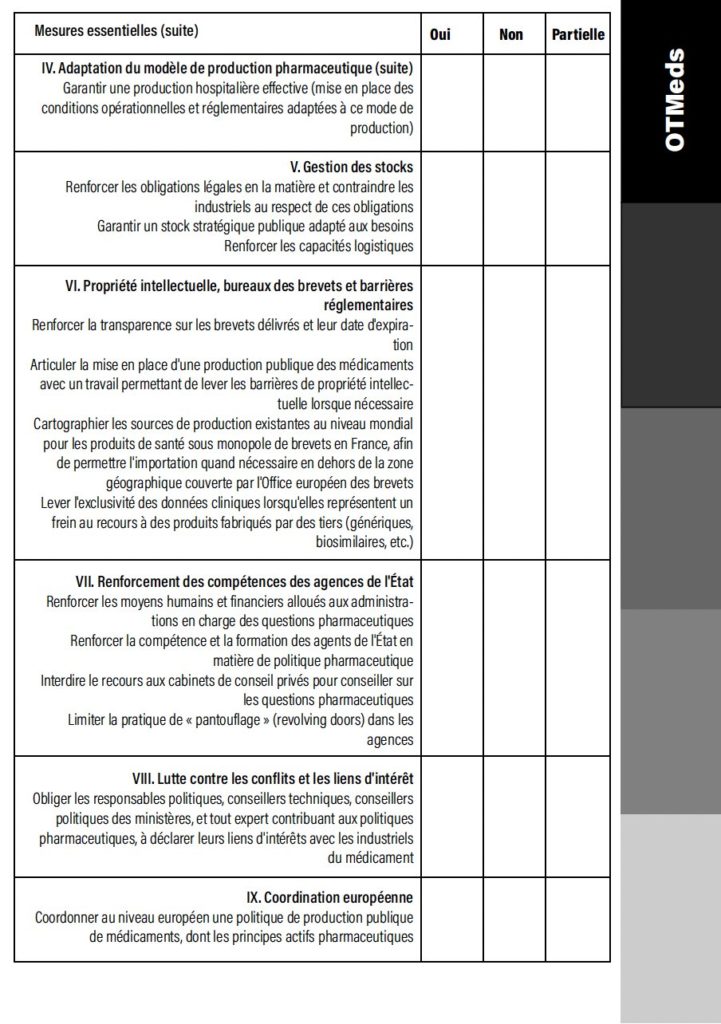
| Assurer une production locale principalement publique d’une partie des phases de façonnage et de conditionnement | |
| Mettre en place un pôle publique du médicament, qui coordonne une partie de cette production en s’appuyant sur une expertise et une gouvernance interdisciplinaires | |
| Garantir une production hospitalière effective (mise en place des conditions opérationnelles et réglementaires adaptées à ce mode de production) | |
| V Gestion des stocks | |
| Renforcer les obligations légales en la matière et contraindre les industriels au respect de ces obligations | |
| Garantir un stock stratégique publique adapté aux besoins | |
| Renforcer les capacités logistiques | |
| VI Propriété intellectuelle, bureau des brevets et barrières réglementaires | |
| Renforcer la transparence sur les brevets délivrés et leur date d’expiration | |
| Articuler la mise en place d’une production publique des médicaments avec un travail permettant de lever les barrières de propriété intellectuelle lorsque nécessaire | |
| Cartographier les sources de production existantes au niveau mondial pour les produits de santé sous monopole de brevets en France, afin de permettre l’importation quand nécessaire en dehors de la zone géographique couverte par l’Office européen des brevets | |
| Lever l’exclusivité des données cliniques lorsqu’elles représentent un frein au recours à des produits fabriqués par des tiers (génériques, biosimilaires, etc.) | |
| VII Renforcement des compétences des agences de l’État | |
| Renforcer les moyens humains et financiers alloués aux administrations en charge des questions pharmaceutiques | |
| Renforcer la compétence et la formation des agents de l’État en matière de politique pharmaceutique | |
| Interdire le recours aux cabinets de conseil privés pour conseiller sur les questions pharmaceutiques | |
| Limiter la pratique de « pantouflage » (revolving doors) dans les agences | |
| VIII Lutte contre les conflits et les liens d’intérêt | |
| Obliger les responsables politiques, conseillers techniques, conseillers politiques des ministères, et tout expert contribuant aux politiques pharmaceutiques, à déclarer leurs liens d’intérêts avec les industriels du médicament | |
| IX Coordination européenne | |
| Coordonner au niveau européen une politique de production publique de médicaments, dont les principes actifs pharmaceutiques |
1 Cette liste n’est pas exhaustive et pourra évoluer.